【五分钟讲实验】免疫组化背景问题分析及解决方案!
时间:2023-12-25 阅读:2401. 蛋白质疏水相互作用产生的背景
在水性介质中,当大分子的表面张力低于水的表面张力时,就会发生疏水相互作用。疏水力是成功结合Ag-Ab的关键,但它们也会产生不可接受的背景。由于相邻组织蛋白内部和之间反应性ε和α-氨基酸的交联,通过与含醛固定剂固定,组织蛋白变得更疏水。
固定过程中蛋白质疏水性的增加增加了免疫组织化学程序中的背景染色;因此,应避免长时间固定在福尔马林或其他醛类固定剂中。这种过度固定引起的背景染色可以通过使用Bouin固定剂、Zenker固定剂或B5固定剂进行后固定来补救。
Ig也是疏水性很强的蛋白质,尤其是IgG的Abs1和IgG3子导致疏水性增加的聚集和聚合是Igs储存过程中观察到的另一个问题。组织切片中偶联物和极性基团之间的蛋白质-蛋白质相互作用也会产生背景。Igs疏水性增加的另一个原因是Abs的生物素化,它可以改变它们的pI。
有几种方法可以减少Ig和组织蛋白的疏水结合,包括pH值与抗体pI不同的稀释缓冲液(特别是对于单克隆抗体);离子强度低(盐浓度低)的稀释剂;在稀释剂中加入非离子洗涤剂(例如吐温20、TritonX)或乙二醇;或提高用于多克隆抗体的稀释剂的pH值。
减少疏水相互作用背景的最常见方法,在原代抗体孵育之前使用封闭蛋白:用正常血清阻断非特异性背景。在一抗(左)之前添加的正常血清将阻断一抗血清的非特异性结合。当不使用封闭(右)时,一抗可以结合产生背景的组织切片中的不相关抗原(蓝色子弹是一抗靶向的抗原)。
通常,它与同一物种的Igs一起进行到次级链接或标记Ab;然而,可以使用牛血清白蛋白、鱼明胶、胎牛血清、脱脂奶粉,以及最近的酪蛋白。酪蛋白似乎比正常血清更有效地阻断疏水性背景染色。
2. 离子和静电相互作用产生的背景
离子相互作用是控制Ag-Ab相互作用的主要力量之一,但它们也有助于非特异性背景。大多数Abs的pI范围为5.8至8.5。11在稀释缓冲液中常用的pH值下,Abs可以具有净负电荷或正表面电荷,如果后者具有相反的净表面电荷,则可以预期Igs和组织蛋白之间的离子相互作用。
Igs与带负电荷的组织或细胞(例如内皮、胶原蛋白)的非免疫结合可以通过具有高离子强度的稀释缓冲液有效阻断。含有1%硫酸锌、0.01M柠檬酸盐(pH6.0)或0.01MTris(pH9.0)的AR可导致非特异性核染色。
如果固定液的离子强度增加,则某些Ags的检测会得到改善。解决免疫组织化学中的非特异性背景染色变得更加复杂,因为意识到很多时候,这种非特异性染色是离子和疏水相互作用相结合的结果,并且如前所述,一种相互作用的补救措施会加重另一种。
3. 内源性过氧化物酶活性
天然存在于红细胞(假过氧化物酶)、粒细胞(髓过氧化物酶)和神经元中的酶活性可与DAB反应,产生与特异性免疫染色无法区分的棕色产物。尽管在福尔马林固定过程中内源性过氧化物酶活性几乎完全被破坏,但用稀释的(0.003-3%)H₂O₂对组织切片进行预处理在甲醇中将进一步降低或完全消除红细胞的假过氧化物酶活性和髓系细胞中的过氧化物酶活性。
在大量出血或酸性血红素的组织切片中,更强(10%)H₂O₂的溶液可能需要去除这种内源性活动,或在浓度较低的溶液中孵育更长时间。H₂O₂用途–不建议将甲醇用于检测细胞表面Ags的标本;此外,使用甲醇可能会将冷冻切片从载玻片上分离出来。在这些情况下,内源性过氧化物酶活性可以被(0.3%)H₂O₂的混合物抑制在0.1%叠氮化钠溶液中或H₂O₂用蒸馏水稀释。使用非常灵敏的检测系统时,内源性过氧化物酶背景可能更明显。为了减少这种背景,H₂O₂需要增加浓度或使用替代酶。其他对Ag检测有不同影响的方法也抑制内源性过氧化物酶活性。
4. 内源性碱性磷酸酶
AP作为报告分子的使用正在增加,因为它促进了双重免疫标记并避免了造血组织中发现的大多数内源性过氧化物酶活性问题。哺乳动物组织中AP的两种同工酶可以用AP方法产生背景染色:肠道和非肠道形式。非肠道形式很容易被1mM左旋咪唑(l-四咪唑)抑制,而来自小牛肠的同工酶(在免疫碱性方法中用作报告分子)不受影响。肠道亚型可以用1%的乙酸阻断,但它会破坏一些Ags。内源性碱性磷酸酶在常规福尔马林固定和加工过程中也会被破坏。已经报道了抑制内源性AP的其他方法。
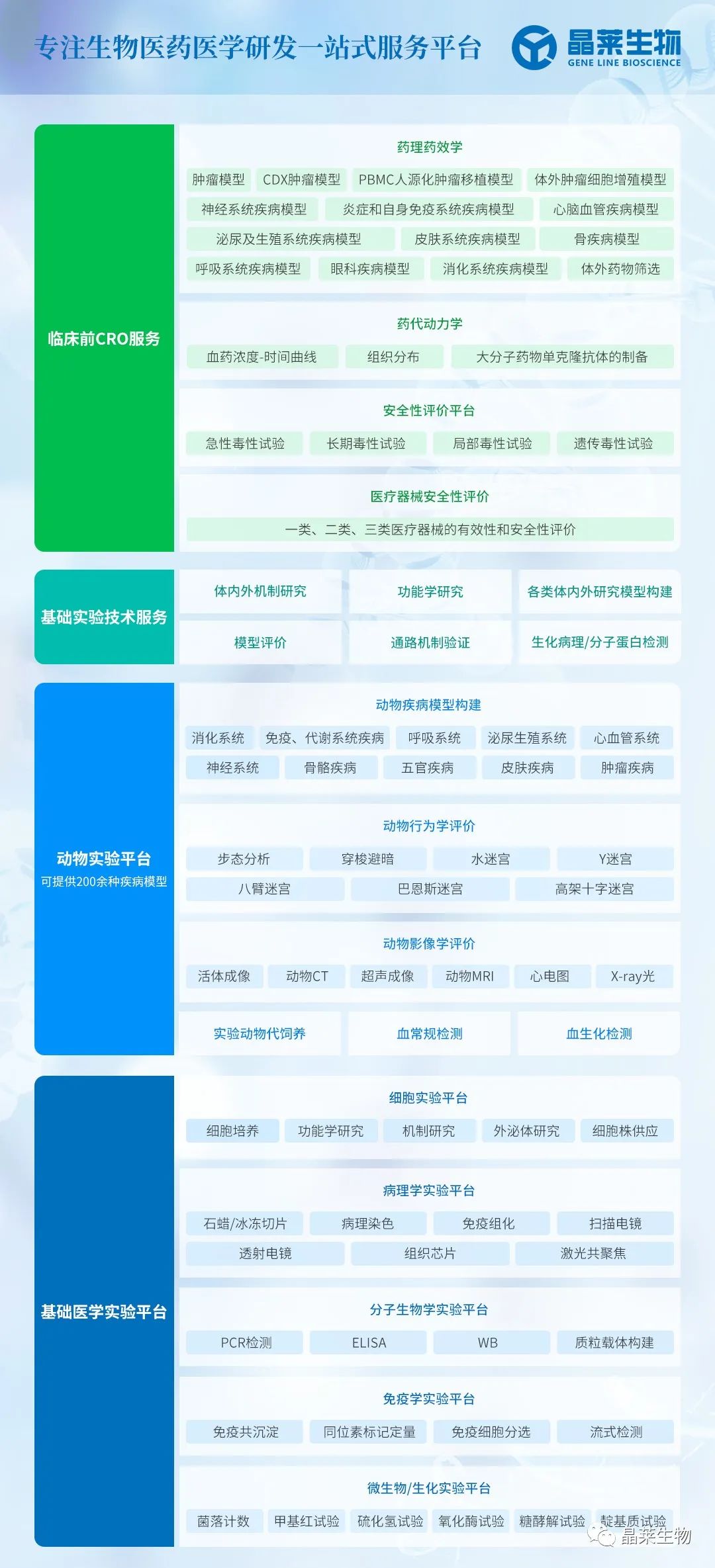
5. 亲和素和生物素
碱性蛋清亲和素对带相反电荷的细胞分子(如核酸、磷脂和肥大细胞质中的糖胺聚糖)的高离子吸引力可能导致非特异性结合。蛋清亲和素在pH值为10.0时具有pI,并且在免疫染色中使用的几乎中性的pH值下具有碱性正电荷。这种非免疫结合可以通过制备pH值为9.4而不是7.6的ABC或LAB溶液或添加5%的脱脂奶粉溶液来防止。用链霉亲和素(来自亲和链霉菌)取代蛋清中的亲和素,其pI值为5.5-6.5,可显著降低IHC方法中的非特异性结合。
内源性生物素广泛分布于哺乳动物组织中,特别是在肝、肺、脾、脂肪组织、乳腺、肾脏和大脑中。福尔马林固定后,内源性生物素的背景大大减弱,但在冷冻切片中可以明显。一些肿瘤细胞可能具有含有生物素的核内包涵体;妊娠期和产后的子宫内膜细胞也可能含有核内生物素包涵体。
检测系统中使用的亲和素与内源性生物素的结合会产生很强的背景,需要加以抑制。这种结合可以通过碱性缓冲液、用未标记的亲和素和生物素预孵育组织切片来抑制,或用脱脂奶粉孵育。
一些含有0.1%链霉亲和素和0.01%生物素的商业试剂盒可阻断这种内源性活性。这可能会干扰核抗原染色(增殖标志物、疱疹感染)的解释。
内源性亲和素-生物素活性 (EABA)。在这种情况下,亲和素-生物素-过氧酶复合物将非特异性结合组织,产生强背景。
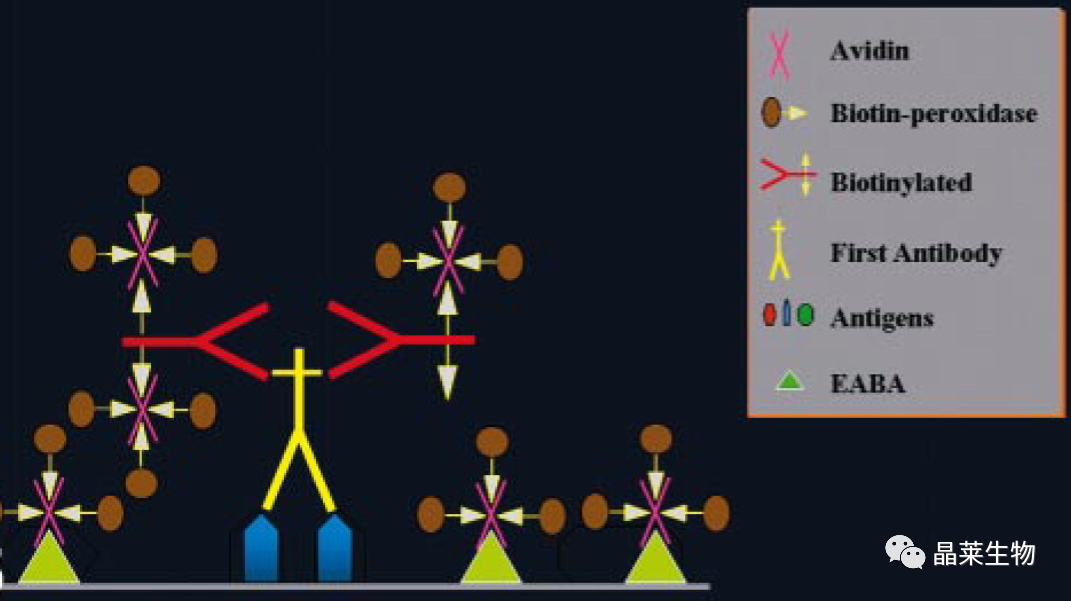
阻止 EABA。在免疫反应前添加未标记的亲和素和生物素将通过EABA阻断非特异性背景。
6. 游离醛
假阳性染色可能是由于偶联抗体与组织中存在的含醛固定剂引入的游离醛基团的非特异性结合所致。这个问题在使用戊二醛时更为常见,但长时间固定在甲醛中也会产生游离醛。不同的化合物(硼氢化钠、氯化铵、碳酸铵缓冲液、赖氨酸、甘氨酸)消除这种结合。
7. Fc受体
单核血细胞的Fc受体可以与抗血清的IgG结合,但这对于常规固定的石蜡包埋组织来说通常不是问题,因为Fc受体在此过程中被破坏。然而,当淋巴组织的轻度固定、冷冻切片或含有Fc受体细胞的细胞学制剂时,可能会发生原抗血清对组织的非特异性粘附。
由于Igs的Fc部分被胶原纤维中存在的碱性基团吸引,石蜡切片也可能发生非特异性染色。F(ab′)的用途2Igs的片段而不是整个Ig分子消除了Fc受体或Igs的Fc部分的非特异性背景。
8. 非特异性抗原扩散
可溶性蛋白从其组成细胞中扩散并被其他不同谱系的细胞或细胞间质非特异性隔离是甲状腺球蛋白检测中的常见问题;它也可以与肌红蛋白、神经胶质纤维酸性蛋白和其他细胞蛋白一起观察到。
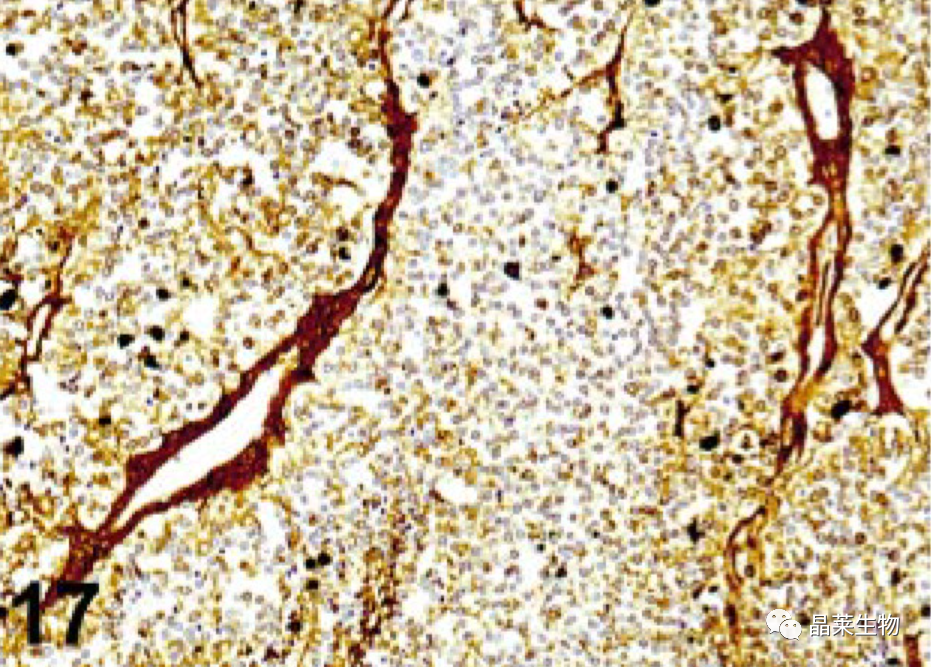
举例:抗原扩散背景;甲状腺癌。该切片中结缔组织和间质被甲状腺球蛋白抗体染色的强烈染色是甲状腺球蛋白因固定不充分而扩散的结果。
9. 颜料
含有丰富黑色素或黑色色素的组织,如含铁血黄素,可降低免疫细胞化学反应的信噪比。如果色素与所检查的 Ag 存在于同一细胞中,则可能无法解释。或者,可以使用产生不同颜色沉淀物的检测系统。另一种可能性是使用高锰酸钾来阻断黑色素,但这会损害某些表位。这种治疗的替代方法是在免疫反应完成后使用吉姆萨染色或 Azure B 染料作为复染剂;黑色素会染成绿色或蓝绿色,DAB产品将保持棕色。
对于含铁血黄素,在pH 5.0乙酸盐缓冲液中加入1%的连二亚硫酸盐溶液5分钟可完全消除含铁血黄素并降低背景。
关于晶莱
关注公众号,了解更多!