【备战2019国自然之自噬研究】是什么原因让诺奖选择它
时间:2018-10-23 阅读:2258自噬是近年来十分热门的领域,2016年诺贝尔生理学或医学奖授予发现细胞自噬机制的日本科学家大隅良典,可见自噬在医学领域的重要性。近几年的国自然项目中,关于自噬的研究也越来越多,据不完全统计,2017年有超过200项自噬相关研究获得国自然面上项目资助,而2018年自噬相关研究中标586项,从总数上看自噬领域依然火爆。
自噬及其生物学功能
细胞自噬(Autophagy)是真核生物中一种由溶酶体介导的高度保守的降解过程。在能量匮乏,活性氧累积等各种胁迫条件下时,细胞通过形成双层膜结构的自噬小体,包裹一部分胞内物质并将其运送到溶酶体进行降解和重新利用,从而维持细胞的存活。
根据胞内底物运送到溶酶体的方式不同,哺乳动物细胞自噬可分为三种主要方式:巨自噬(Macroautophagy)、微自噬(Microautophagy)和分子伴侣介导的自噬(Chaperone-mediatedautophagy)。通常我们所研究的是巨自噬,简称自噬。
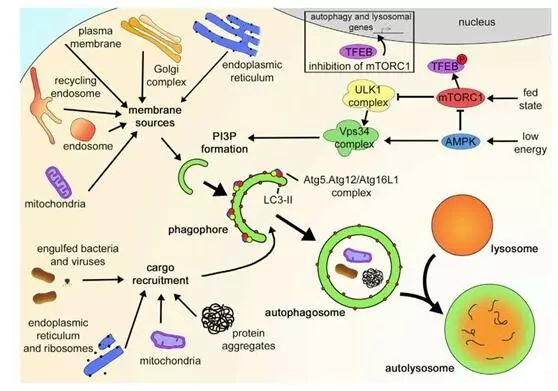
图1.自噬过程
细胞在受到外界刺激信号的情况下,在细胞内形成双层膜结构,这些膜包被内吞的细菌和病毒、内质网和核糖体、线粒体、细胞质内聚集的蛋白质等,形成自噬泡(phagophore)、自噬体(autophagosome)、自噬溶酶体(autolysosome),最终将内容物降解(degradation)。自噬的形成和周转受mTORC1、AMPK、ULK1、Vps34和Atgs等严格调控。
在生理条件下,自噬可以清除受损的细胞器如线粒体以及蛋白质聚合体,起到细胞内“清道夫”的功能,从而维持细胞的稳态平衡。可以说,自噬参与着组织、器官和个体的生长、发育、衰老、死亡的各个阶段,而自噬异常则常常与人类神经退行性疾病、糖尿病、肿瘤等疾病的发生发展密切相关,自噬通路是很多疾病潜在的靶向通路。
自噬信号通路
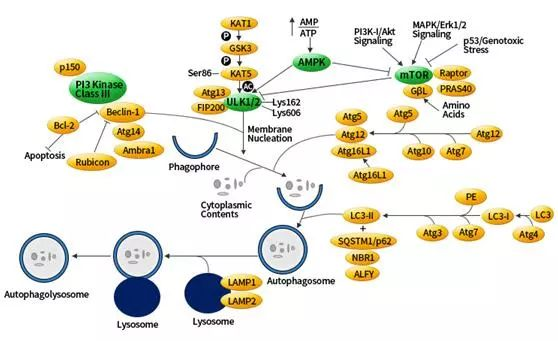
图2.自噬信号通路解析.
mTOR 激酶是自噬中的关键分子, PI3K-I/Akt 和 MAPK 信号通路可以激活mTOR,抑制自噬;AMPK 和 p53信号通路负调控 mTOR ,促进自噬。
ULK1/2是自噬信号通路唯一具有丝氨酸/苏氨酸激酶活性的核心蛋白。在自噬溶酶体组装前自噬信号通过ULK1/2、FIP200 和 Atg13 组成的ULK 复合物活化介导。ULK1 复合物是连接上游mTOR 和 AMPK 与下游自噬体形成的桥梁。
在饥饿条件下 AMPK 活化,mTOR 失活,活化的 AMPK 催化ULK1 第 317、467、555、574、637 和 777 位丝氨酸发生磷酸化从而促进自噬。在营养充足的情况下 AMPK 失活,mTOR 可与 ULK1 第 757 位丝氨酸结合抑制 ULK1-AMPK 的相互作用,导致 ULK1 的失活,最终关闭自噬信号。
III 类 PI3K 复合体,包括了Beclin-1、p150和 Atg14,都是自噬诱导所需要的。Bcl-2 能抑制 Beclin-1 依赖的自噬,所以它既具有促生存的功能又具有抑制自噬的功能。LC3/Atg8 的 C 端被 Atg4酶切后生成细胞质 LC3-I。
LC3-I 与磷脂酰乙醇胺 (PE) 也以泛素样反应的方式连接,这个反应需要 Atg7 和 Atg3。 LC3 的脂质形式,即LC3-II,吸附在自噬体膜上。从而将 LC3 与自噬小泡联系起来。自噬体中 LC3 的存在,及其向低迁移形式的 LC3-II 的转化被作为自噬发生的“指示器”。LAMP1/2是溶酶体相关膜蛋白,相关抗体可用于标记溶酶体。
自噬研究策略和方法
正常细胞基础水平自噬活性比较低,对自噬研究通常需要进行人工调节和干预,常用药物有:
自噬诱导剂
a) BredeldinA / Thapsigargin / Tunicamycin :模拟内质网应激
b) Carbamazepine/L-690,330/ LithiumChloride(氯化锂):IMPase 抑制剂(即Inositolmonophosphatase,肌醇单磷酸酶)
c) Earle's平衡盐溶液:制造饥饿
d) N-Acetyl-D-sphingosine(C2-ceramide):ClassI PI3K Pathway抑制剂
e) Rapamycin:mTOR抑制剂
f) XestosponginB/C:IP3R阻滞剂
自噬抑制剂
a) 3-Methyladenine(3-MA):(ClassIII PI3K) hVps34 抑制剂
b) BafilomycinA1:质子泵抑制剂
c) Hydroxychloroquine(羟氯喹)
自噬的评估通常采用多个自噬阶段的标志物,因为自噬小体数量的增加可能是自噬上调也可能是自噬最后阶段降解被抑制所致,所以设置合适的对照很有必要。
1.电子显微镜
透射电镜技术(TEM)被广泛用于检测自噬过程中形成的各种结构,从吞噬泡、自噬体到自噬溶酶体。吞噬泡的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。自噬溶酶体的特征为:单层膜,胞浆成分已降解。
2.检测标志物LC3/Atg8和p62/SQSTM1
在自噬过程中,非激活型胞质LC3(LC3-I)经水解和脂质化后转变为激活型LC3-II,LC3-II与自噬小体膜结合。通过WB可以观察到更小的LC3-II,IHC/IHF可以观察到LC3在胞浆和膜结构上的分布。
p62降解是另一个常用的标志物,它在自噬清除多泛素化蛋白时会被优先降解。
3.检测Lamps、Atg5、Atg14和Beclin-1
Lamp-1和Lamp-2是溶酶体的标志物,Atg5、Atg14和Beclin-1是吞噬泡和自噬小体的标志物,这些抗体通常被用于IHC、WB和流式细胞术监测自噬过程。
4.组织蛋白酶Cathepsin活力检测
荧光标记的组织蛋白酶底物可通过报告cathepsin B,KL的蛋白酶活力来发现活细胞中的溶酶体。这些可渗透细胞的无毒试剂加入到细胞中被cathepsin降解后产生荧光,与细胞核燃料如Hoechst及溶酶体和细胞器标志物如acridine orange联用,可检测自噬水平。
5.检测自噬潮autophagic flux
自噬是一个动态过程,自噬潮是一个动态连续的概念,涵盖了自噬体形成、自噬性底物向溶酶体的运送以及降解过程,对整个过程进行监测较单纯定量自噬小体数量更能反映自噬活性。可采用GFP-LC3单荧光和mRFP-GFP-LC3双荧光指示体系结合活细胞技术跟踪自噬过程。
自噬研究范式
通常情况下,除了研究自噬现象本身,大家更多的是将自噬与各种生命活动或者疾病结合起来,把自噬作为这些方向的一个机制来研究。比如研究自噬如何参与肿瘤的发生发展、如何参与肿瘤的耐药性与复发转移、如何参与肿瘤免疫治疗的效果、如何参与炎症反应、如何参与氧化应激,如何参与自闭症、阿尔兹海默症的发生与治疗等,通常的研究模式:
1.证明自噬参与了相关研究表型(电镜、LC3II/I-WB、LC3亚细胞定位、LC3荧光示踪监测自噬流等)
2.证明自噬在表型中起到关键作用(通过自噬抑制剂、激动剂进行关联研究)
3.找到表型与自噬桥梁分子(检测pI3K通路、Beclin-1、ATG家族各成员)
4.在基因层面通过gain of/lost of function研究桥梁分子在自噬中的作用。
自噬相关研究领域
1.自噬起始和终止的分子机制
自噬领域的一个重要问题是细胞在应激条件下如何快速激活和终止自噬。这方面的研究焦点在于:通过蛋白翻译后修饰和蛋白-蛋白相互作用研究自噬相关蛋白复合物如何动态调节自噬。
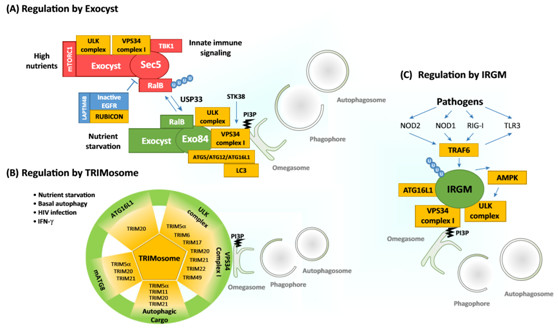
图3.细胞自噬起始复合物的调节.
参见EmergingMechanisms in Initiating and Terminating Autophagy. Trends Biochem Sci. 2017 Jan;42(1):28-41.
2.细胞自噬与肿瘤
正常生理情况下,细胞自噬利于细胞保持自稳状态;在发生应激时,细胞自噬防止有毒或致癌的损伤蛋白质和细胞器的累积,抑制细胞癌变;然而肿瘤一旦形成,细胞自噬为癌细胞提供更丰富的营养,促进肿瘤生长。因此,因此自噬在肿瘤发生发展和治疗中是一把双刃剑,存在时相和肿瘤微环境的特异性。
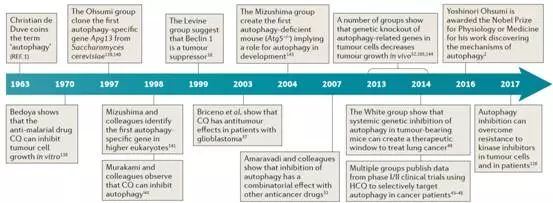
图4. 自噬在肿瘤治理中的重要发现.
参见Targetingautophagy in cancer. Nat Rev Cancer.2017 Sep;17(9):528-542.
3.细胞自噬与免疫
越来越多的证据表明,自噬在先天免疫和适应性免疫中扮演重要角色。免疫细胞利用自噬监测入侵病源及自身状态,自噬在先天免疫中的作用包括调节炎症小体和细胞特异性PRR信号,清除凋亡体,控制炎症。在适应性免疫中,自噬通路对抗原提呈,淋巴细胞发育、生存和稳态必不可少。
很多研究发现,自噬的失调与风湿性关节炎密切相关。
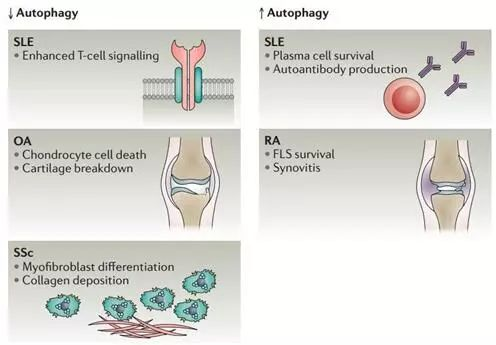
图5. 在风湿性疾病中,自噬的失调改变细胞命运.
参见:Autophagy: controlling cell fate in rheumatic diseases. Nat Rev Rheumatol. 2016Sep;12(9):517-31.
自噬参与炎症信号通路的调节
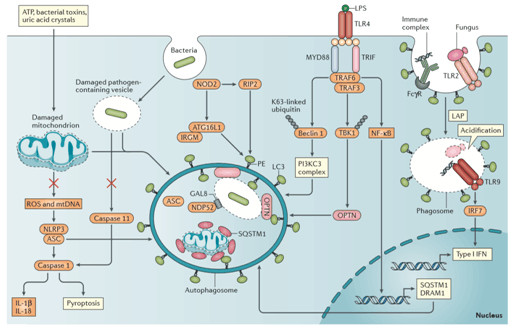
图6. 自噬和炎症信号通路的Crosstalk.
参见Crosstalk between autophagy and inflammatory signalling pathways:balancing defence and homeostasis. NatRev Immunol. 2016 Nov;16(11):661-675.
a.细胞自噬与神经退行性疾病. 参见Autophagy and Neurodegeneration:Pathogenic Mechanisms and Therapeutic Opportunities. Neuron. 2017 Mar 8;93(5):1015-1034.
b.激活自噬促进免疫化疗和放疗. 参见Activating autophagy to potentiateimmunogenic chemotherapy and radiation therapy. Nat Rev Clin Oncol. 2017 Apr;14(4):247-258.
c.植物里的自噬. 参见Autophagy in Plants--What's New on theMenu? Trends Plant Sci. 2016Feb;21(2):134-44.
d.表观遗传学与细胞自噬的关系. 参见Epigenetic Control of Autophagy: NuclearEvents Gain More Attention.Mol Cell.2017Mar 2;65(5):781-785.
e.蛋白泛素化修饰和自噬. 参见The Ubiquitin Code in theUbiquitin-Proteasome System and Autophagy.Trends Biochem Sci. 2017 Nov;42(11):873-886.
f.药物治疗自噬. 参见Pharmacological modulation of autophagy:therapeutic potential and persisting obstacles. Nat Rev Drug Discov.2017 Jul;16(7):487-511.











